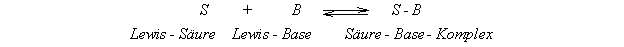Das HSAB- Konzept von Pearson
Das Konzept von Pearson baut auf dem Konzept von Lewis auf und läßt
somit Redoxreaktionen außer Betracht. Bei seinem Konzept geht Pearson
davon aus, daß jede chemische Bindung als eine Vereinigung einer
Lewis-Säure mit einer Lewis- Base zu einem Säure-Base Komplex
beschrieben werden kann. 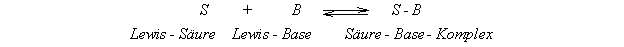
Das HSAB-Konzept von Pearson versucht Aussagen über die Lage des
Säure-Base-Gleichgewichtes zu machen und über die Stabilitiät des
resultierenden Säure-Base-Komplexes.
Als entscheidend für seine Betrachtungen erachtete er die
Polarisierbarkeit (d.h. Deformierbarkeit) der Elektronenhülle und die
Elektronegativität der beteiligten Teilchen. Es gelten daher folgende
Definitionen:
Harte Säuren:
Lewis-Säuren mit geringer Polarisierbarkeit. Dies gilt für kleine und
hochgeladene Kationen sowie Moleküle, in denen der elektronegative
Bindungspartner eine hohe positive Ladung am zentralatom induziert.
Weiche Säuren:
Lewis-Säuren mit hoher Polarisierbarkeit, wie sie in Kationen mit
niedriger Ladung und großem Radius bzw. in Atom und Molekülen mit
besetzten äußeren Orbitalen (leicht zu entfernenden Valenzelektronen)
auftritt.
Harte Basen:
Lewis-Basen mit gr0ßer Elektronegativität und entsprechend geringer Polarisierbarkeit.
Weiche Basen:
Lewis-Basen mit geringer Elektronegativität und größerer Polarisierbarkeit.
Harte Säuren kombinieren bevorzugt mit harten Basen, weiche Säuren bevorzugt mit weichen Basen.
Dabei gehen harte Säuren und harte Basen Bindungen mit überwiegend
ionische Charakter ein, dagegen überwieg in der Bindung weicher Säuren
mit weichen Basen der kovalente Bindungscharakter.