Säure- Base- Definitionen
Das Konzept von Arrhenius und Ostwald
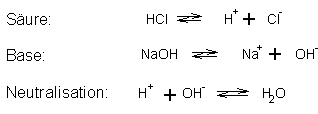 Auf
der Grundlage ihrer Untersuchungen zur elektrolytischen Dissoziation
wurden 1884 von Arrhenius folgende Definitionen entwickelt:
Säuren sind Wasserstoffverbindungen (konstitutionelles Merkmal), die in
wäßriger Lösung Wasserstoffionen H liefern
(funktionelles Kriterium).
Basen sind Hydroxylverbindungen konstitutionelles Merkmal), die in
wäßriger Lösung Hydroxidionen OH-
bilden (funktionelles Kriterium).
Die Bildung der für Säuren bzw. Basen charakteristischen Ionen wird
durch Dissoziation der Moleküle in wäßriger Lösung erklärt:
Die Umsetzung äquivalenter Mengen einer Säure und einer Base wird als
Neutralisation bezeichnet. Die der Neutralisation zu Grunde liegende
Reaktion ist die Vereinigung von H und OH-
- Ionen zu undissoziierten Wasser.
Mit Hilfe der von Arrhenius gegebenen definitionen war es erstmals
möglich, die Stärke von Säuren und Basen durch die
Gleichgewichtskonstante der zu Grunde liegenden Dissoziationsreaktion
zu beschreiben. Ebenso konnte durch die Festlegung der
Neutralitätsbedingung [H ] = [OH-]
der sauere bzw. basische Charakter einer wäßrigen Lösung eindeutig
beschrieben werden.
Auf
der Grundlage ihrer Untersuchungen zur elektrolytischen Dissoziation
wurden 1884 von Arrhenius folgende Definitionen entwickelt:
Säuren sind Wasserstoffverbindungen (konstitutionelles Merkmal), die in
wäßriger Lösung Wasserstoffionen H liefern
(funktionelles Kriterium).
Basen sind Hydroxylverbindungen konstitutionelles Merkmal), die in
wäßriger Lösung Hydroxidionen OH-
bilden (funktionelles Kriterium).
Die Bildung der für Säuren bzw. Basen charakteristischen Ionen wird
durch Dissoziation der Moleküle in wäßriger Lösung erklärt:
Die Umsetzung äquivalenter Mengen einer Säure und einer Base wird als
Neutralisation bezeichnet. Die der Neutralisation zu Grunde liegende
Reaktion ist die Vereinigung von H und OH-
- Ionen zu undissoziierten Wasser.
Mit Hilfe der von Arrhenius gegebenen definitionen war es erstmals
möglich, die Stärke von Säuren und Basen durch die
Gleichgewichtskonstante der zu Grunde liegenden Dissoziationsreaktion
zu beschreiben. Ebenso konnte durch die Festlegung der
Neutralitätsbedingung [H ] = [OH-]
der sauere bzw. basische Charakter einer wäßrigen Lösung eindeutig
beschrieben werden.
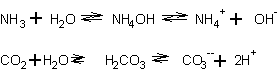 Aber diese Definitionen haben auch eine Reihe von Schwächen:
Aber diese Definitionen haben auch eine Reihe von Schwächen:
1. Beschränken sich die Definitionen auf wäßrige Systeme.
2. Es gibt Substanzen, die nicht über die geforderten strukturellen
Merkmale verfügen und trotzdem saure oder basische Reaktionen in Wasser
zeigen. Typische Vetreter sind dabei Ammoniak und Kohlendioxid.
Teilweise gelang dann die Erklärung dieser Eigenschaften über den Umweg
einer Reaktion mit Wasser und anschließender Dissoziation.
3. In wäßriger Lösung liegt kein H vor, sondern
das Hydronium- Ion H3O
und seine Hydrate.
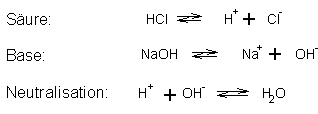 Auf
der Grundlage ihrer Untersuchungen zur elektrolytischen Dissoziation
wurden 1884 von Arrhenius folgende Definitionen entwickelt:
Säuren sind Wasserstoffverbindungen (konstitutionelles Merkmal), die in
wäßriger Lösung Wasserstoffionen H liefern
(funktionelles Kriterium).
Basen sind Hydroxylverbindungen konstitutionelles Merkmal), die in
wäßriger Lösung Hydroxidionen OH-
bilden (funktionelles Kriterium).
Die Bildung der für Säuren bzw. Basen charakteristischen Ionen wird
durch Dissoziation der Moleküle in wäßriger Lösung erklärt:
Die Umsetzung äquivalenter Mengen einer Säure und einer Base wird als
Neutralisation bezeichnet. Die der Neutralisation zu Grunde liegende
Reaktion ist die Vereinigung von H und OH-
- Ionen zu undissoziierten Wasser.
Mit Hilfe der von Arrhenius gegebenen definitionen war es erstmals
möglich, die Stärke von Säuren und Basen durch die
Gleichgewichtskonstante der zu Grunde liegenden Dissoziationsreaktion
zu beschreiben. Ebenso konnte durch die Festlegung der
Neutralitätsbedingung [H ] = [OH-]
der sauere bzw. basische Charakter einer wäßrigen Lösung eindeutig
beschrieben werden.
Auf
der Grundlage ihrer Untersuchungen zur elektrolytischen Dissoziation
wurden 1884 von Arrhenius folgende Definitionen entwickelt:
Säuren sind Wasserstoffverbindungen (konstitutionelles Merkmal), die in
wäßriger Lösung Wasserstoffionen H liefern
(funktionelles Kriterium).
Basen sind Hydroxylverbindungen konstitutionelles Merkmal), die in
wäßriger Lösung Hydroxidionen OH-
bilden (funktionelles Kriterium).
Die Bildung der für Säuren bzw. Basen charakteristischen Ionen wird
durch Dissoziation der Moleküle in wäßriger Lösung erklärt:
Die Umsetzung äquivalenter Mengen einer Säure und einer Base wird als
Neutralisation bezeichnet. Die der Neutralisation zu Grunde liegende
Reaktion ist die Vereinigung von H und OH-
- Ionen zu undissoziierten Wasser.
Mit Hilfe der von Arrhenius gegebenen definitionen war es erstmals
möglich, die Stärke von Säuren und Basen durch die
Gleichgewichtskonstante der zu Grunde liegenden Dissoziationsreaktion
zu beschreiben. Ebenso konnte durch die Festlegung der
Neutralitätsbedingung [H ] = [OH-]
der sauere bzw. basische Charakter einer wäßrigen Lösung eindeutig
beschrieben werden.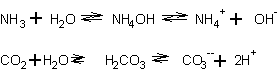 Aber diese Definitionen haben auch eine Reihe von Schwächen:
Aber diese Definitionen haben auch eine Reihe von Schwächen: