Säure- Base Titration
Ein wichtiges Anwendungsgebiet ist die Säure- Base Titration. Dabei
handelt es sich um die maßanalytusche Konzentrationsbestimmung 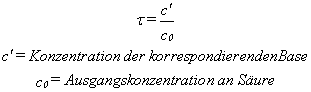 von
Säuren oder Base. Dazu läßt man i. A. Die Lösung einer Säure mit
bekannter Konzentration mit der zu bestimmenden Base (oder umgekehrt)
reagieren. Man bestimmt den Punkt, an dem sich äquivalente Mengen Säure
und Base miteinander umgesetzt haben. Der pH- Wert diese Punktes, der
auch Äquivalenzpunkt gennant wird, kann man mit den vorher
beschriebenen Gleichungen berechnen. Bestimmt wird er entweder durch
Anwendung von pH- Indikatoren bzw. durch Potentialmessungen.
von
Säuren oder Base. Dazu läßt man i. A. Die Lösung einer Säure mit
bekannter Konzentration mit der zu bestimmenden Base (oder umgekehrt)
reagieren. Man bestimmt den Punkt, an dem sich äquivalente Mengen Säure
und Base miteinander umgesetzt haben. Der pH- Wert diese Punktes, der
auch Äquivalenzpunkt gennant wird, kann man mit den vorher
beschriebenen Gleichungen berechnen. Bestimmt wird er entweder durch
Anwendung von pH- Indikatoren bzw. durch Potentialmessungen.
 Wichtige Größen für Titrationen sind:
Wichtige Größen für Titrationen sind:
Der Titrationsgrad tau, wie rechts beschrieben.
Der Titrierexponent pT ist der pH-Wert am Äquivalenzpunkt!
Titriert man eine sehr starke Säure mit einer sehr starken Base, so hat
man auf Grund des nivellierenden Effektes des Wassers nur die Umsetzung
von H < und OH- zu betrachten, was auf eine Betrachtung des
Autoprotolysegleichgewichtes des Wassers hinaus läuft! Das bedeutet
weiterhin, daß der Titerexponent pT = 7 ist ( bei 22°C).
Titration einer mittelstarken Säure mit einer sehr starken Base!
Beispiel: Umsetzung von Essigsäure mit Natronlauge. Die Konzentration an Essigsäure soll bestimmt werden.
Zu Begin der Ttitration gilt Gleichung (1).
Am Äquivalenzpunkt ist die Essigsäure komplett in das Acetat überführt
worden. Für den pH- Wert gilt in anloger Weise zum pH- Wert
mittelstarker Säuren, die daraunter hergeleitete Gleichung (2).
 Beispiel:
Beispiel:
0,1 M Essigsäure mit Natronlauge (0,1M):
pKB ( CH3COO-) = 9,25
pH = 14 - 0,5 *( 9,25 1) = 8,875 = pT
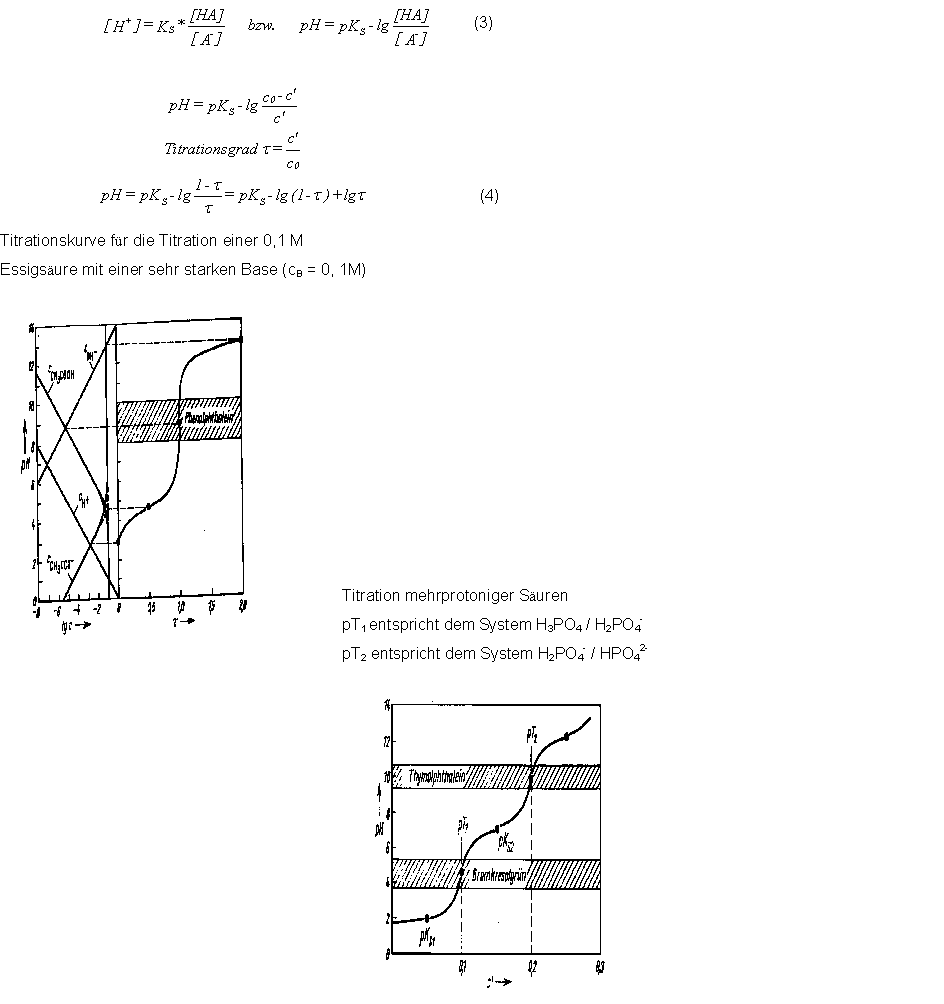
Den Verlauf zwischen tau= 0 und tau= 1 erhält man durch folgende
Überlegungen (vgl. rechts). Für das Protolysegleichgewicht einer Säure
gilt Gleichung (3).
Vernachlässigt man den durch Protolyse der Säure gebildeten Anteil
[A-], so kann man [A-] durch die während der Titration zugesetzte Base
c' ersetzen ([A-] = c'). Fur die Konzentration an [HA] gilt weitehin
[HA]= c0 - c'.
Daraus resultiert dann Gleichung (4)
Der pH- Wert zu Begin einer Titration (tau =0 ) hängt vom pKS- Wert und
der Ausgangskonzentration c0 der Säure ab. Unabhängig von c0
durchlaufen die Titrationen einer Säure bei tau= 0,5 den Punkt pH = pKS.
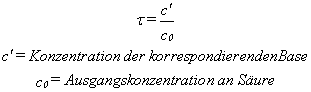 von
Säuren oder Base. Dazu läßt man i. A. Die Lösung einer Säure mit
bekannter Konzentration mit der zu bestimmenden Base (oder umgekehrt)
reagieren. Man bestimmt den Punkt, an dem sich äquivalente Mengen Säure
und Base miteinander umgesetzt haben. Der pH- Wert diese Punktes, der
auch Äquivalenzpunkt gennant wird, kann man mit den vorher
beschriebenen Gleichungen berechnen. Bestimmt wird er entweder durch
Anwendung von pH- Indikatoren bzw. durch Potentialmessungen.
von
Säuren oder Base. Dazu läßt man i. A. Die Lösung einer Säure mit
bekannter Konzentration mit der zu bestimmenden Base (oder umgekehrt)
reagieren. Man bestimmt den Punkt, an dem sich äquivalente Mengen Säure
und Base miteinander umgesetzt haben. Der pH- Wert diese Punktes, der
auch Äquivalenzpunkt gennant wird, kann man mit den vorher
beschriebenen Gleichungen berechnen. Bestimmt wird er entweder durch
Anwendung von pH- Indikatoren bzw. durch Potentialmessungen.  Wichtige Größen für Titrationen sind:
Wichtige Größen für Titrationen sind:  Beispiel:
Beispiel: