Autoprotolyse des Wassers
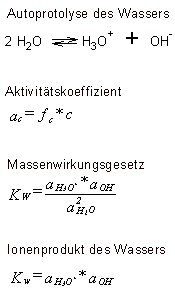 Konvention: Für das hydratisierte Proton wird i. A. H geschrieben!
Konvention: Für das hydratisierte Proton wird i. A. H geschrieben!
Aktivität: In der physikalischen Chemie tritt die Aktivität an die
Stelle der "wahren" Konzentration und drückt demgegenüber die
"wirksame" Konzentration von Atomen, Ionen oder Molekülen aus, d.h. sie
ist das Konzentrationsmaß, das in die für ideale Mischungen und
Lösungen abgeleiteten Gesetze (wie z.B. das Massenwirkungsgesetz)
einzusetzen ist, damit sich diese auch dann anwenden lassen, wenn in
dem betreffenden System kein ideales Verhalten (z.B. in mäßig
verdünnten Elektrolytlösungen infolge der gegenseitigen
Wechselwirkungen der Ionen) mehr vorliegt. Den Anteil der "wirksamen"
an der Gesamtzahl der vorhandenen Atome, Ionen oder Moleküle gibt der
Aktivitätskoeffizient f an.
Oder anders ausgedrückt:
In einer idealen Mischphase ist die Summe der Wechselwirkungen zwischen
den Komponenten gleich der in den reinen Stoffen. In realen Mischungen
treten zusätzliche Wechselwirkungen auf, die zu Abweichungen in allen
Gesetzen führen, welche unter den Bedingungen idealen Verhaltens
abgeleitet wurden (so auch das Massenwirkungsgesetz).
Daher kann man das Massenwirlungsgesetz für die Autoprotolyse des Wassers wie rechtsa angegeben formulieren.
Aus der sehr niedrigen elektrischen Leitfähigkeit reinen Wassers kann
man schlußfolgern, daß das Gleichgewicht der Autoprotolyse des Wassers
weitgehend auf der Seite des reinen Wassers liegt. Das bedeutet
weiterhin, das man die Aktivität des reinen Wassers gleich 1 setzen
kann. Daraus resultiert das Ionenprodukt Kw des Wassers.
Da in das Ionenprodukt nur OH- und H3O sowie H2O eingehen, bleibt das
Ionenprodukt des Wassers auch bei Zugabe anderer Stoffe (Säuren oder
Basen konstant). Bei 22°C ist Kw = 1,0 * 10-14 mol2*l-2. Dabei kann
sich jedoch die Aktivität der H3O bzw. OH-- Ionen in einem großen
Bereich ändern. Es gilt somit für saure Lösungen aH > aOH- und für
basische Lösungen dementsprechend aOH- > aH .
Zur besseren Beschreibung des Charakters verdünnter wäßriger Lösungen wurde der pH-Wert eingeführt:
pH = -lg aH
Ananlog kann man den pOH- Wert und pKW- Wert definieren.
pOH = -lg aOH-
pKw = -lg Kw
Da das Ionenprodukt des Wasser temperaturabhängig ist, gilt für den pH- Wert des reinen Wassers:
18°C ->>> pH = 7,07
22°C ->>> pH = 7,00
100°C ->>> pH = 6,07
Weiterhin gilt für den sauren bzw. basischen Charakter einer Lösung (bei 22°C ) folgende grobe Einteilung:
saure Lösung: [H ] > 10-7 mol*l-1 ->>> pH < 7
neutrale Lösung: [H ] = 10-7 mol*l-1 ->>> pH = 7
basische Lösung:[H ] < 10-7 mol*l-1 ->>> pH > 7
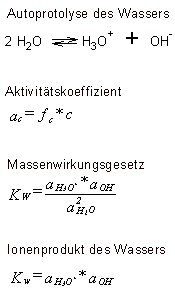 Konvention: Für das hydratisierte Proton wird i. A. H geschrieben!
Konvention: Für das hydratisierte Proton wird i. A. H geschrieben!