Analytische Anwendungen von Komplexen und Komplexgleichgewichten
 Gravimetrie
Gravimetrie
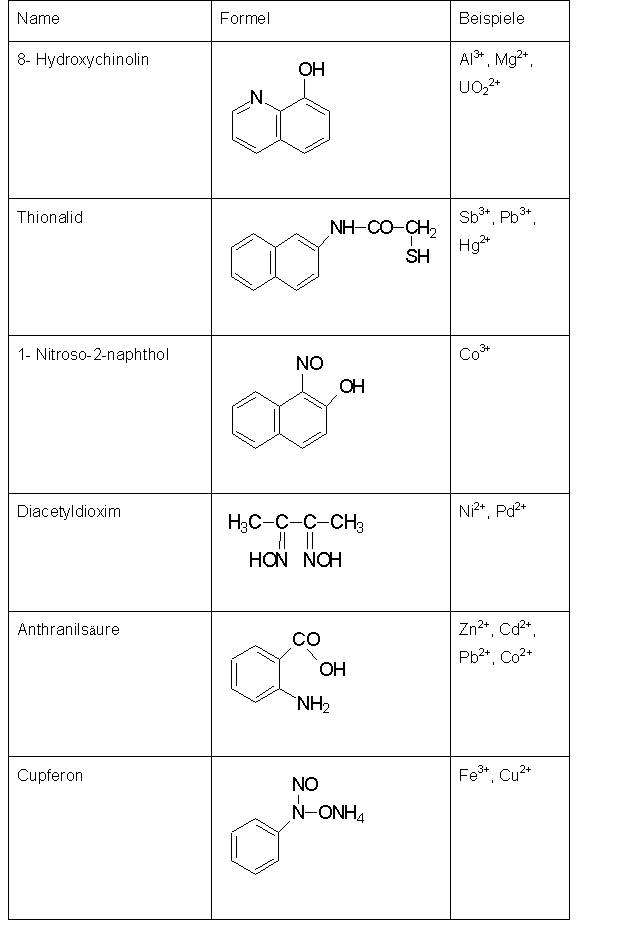
Grundlage für die Anwendung in der Gravimetrie ist die Bildung
schwerlöslicher Komplexe definierter Zusammensetzung. Die Abbildung
zeigt dazu eine Reihe von Komplexbildnern und deren Anwendung.
Maskierung
Unter Maskierung versteht man die Verhinderung bestimmter Reaktionsabläufe.
Durch den Zusatz eines Komplexbildners wird dabei in einem Gemisch die
Konzentration einer Ionensorte soweit herabgesetzt, daß normalerweise
eintretende Reaktionen ausbleiben.
Beispiele:
* Die Maskierung von Pb2 durch Tartrat bei der Fällung von BaSO4.
* Die Maskierung von Cu mit Cyanid als [Cu(CN)4]3- bei der Fällung von CdS.
* Die Maskierung von Fe3 und Cu2 mit EDTA bei der iodometrischen Bestimmung von Chrom in Stählen.
Kompleximetrische Titration
Mit der von Schwarzenbach eingeführten kompleximetrischen Titration ist
man in der Lage, nahezu alle Elemente des Periodensystem direkt oder
indirekt auf maßanlytischen Wege zu bestimmen.
Bei der Nutzung von Chelatbildner ändert sich im Gegensatz zu einzähnigen Liganden
(stufenweise Komplexbildung und geringe Unterschiede in den
Komplexstabilitätskonstanten) am Äquivalenzpunkt die Konzentration an
freien Metallionen sprunghaft. Am häufigsten wird dabei EDTA
eingesetzt, welches im Allgemeinen 1:1- Komplexe bildet.
Vorteile der Anwendung von EDTA:
* exakte Stöchiometrie der Umsetzung
* hohe Stabilität der Komplexe
* rasche Gleichgewichtseinstellung
* pH- Wert abhängig
 Verfahren der kompleximetrischen Titration:
Verfahren der kompleximetrischen Titration:
A) direkte Titration
Endpunktsbestimmung entweder durch Bestimmung des Gehaltes an H - Ionen
( Säure- Base Titration) oder durch den viel genaueren Einsatz von
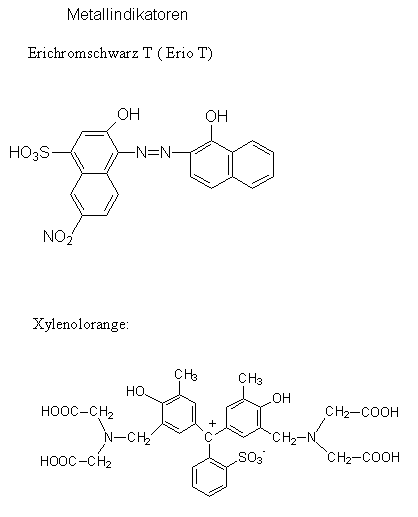
Metallindikatoren.
Metallindikatoren sind Komplexbildner, deren Farbe im freien Zustand und im Komplex unterschiedlich ist.
B) Rücktitration: zur Bestimmung von Metallionen in schwer löslichen Niederschlägen.
Vorgehensweise:
1. Eine definierte Menge (Überschuß) an Komplexbildner zugeben.
2. Überschüssigen Komplexbildner mit Metallsalzösung bestimmen.
C) Verdrängungstitration:
Vorgehensweise:
1. Mit Zn- oder Mg- Komplexonat versetzen.
2. Das Metall (Zn bzw. Mg) wird freigesetzt.
3. Das freigesetzte Metall wird bestimmt.
D) Mehrfachbestimmungen (Möglichkeiten des Vorgehens):
* richtige pH- Wertwahl
* selektive Maskierung
* selektive Fällung
* Redoxmaskierung
* selektive Komplexone
E) indirekte Titration, z. B. zur Bestimmung von Anionen (Beispiel SO42-):
1. Fällung mit einer definierten (überschüssigen) Menge an Ba2 .
2. Bestimmung des Überschusses an Metallionen
3. Differenzbildung
 Gravimetrie
Gravimetrie Verfahren der kompleximetrischen Titration:
Verfahren der kompleximetrischen Titration: