Ionenaustauschgleichgewichte
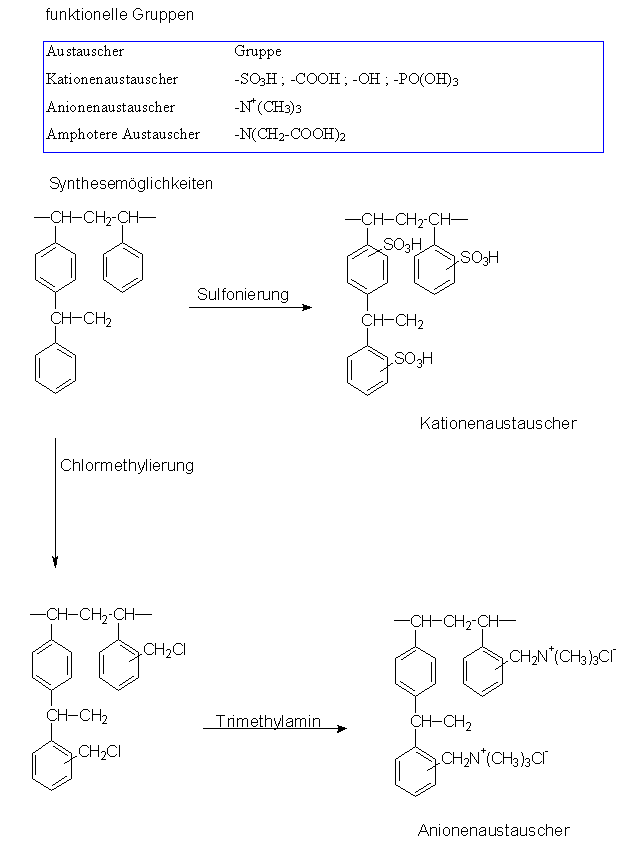 Ionenaustauscher:
Ionenaustauscher sind Feststoffe, die in einer reversiblen Umsetzung
aus einer Lösung Ionen entfernen und dafür eine äquivalente Menge
anderer Ionen in die Lösung abgeben.
Ionenaustauscher:
Ionenaustauscher sind Feststoffe, die in einer reversiblen Umsetzung
aus einer Lösung Ionen entfernen und dafür eine äquivalente Menge
anderer Ionen in die Lösung abgeben.
Die zum Ionenaustausch befähigten Stoffe tragen an einem hochmoleklaren
Gerüst (Matrix) elektrisch geladene Gruppen (Festionen). Die
Elektroneutralität wird durch eine der Festionenkonzentration
entsprechende Menge von Gegenionen gewährleistet. Diese Gegenionen sind
je nach Austauschertyp und damit Bindungsart mehr oder weniger frei
beweglich. Nach der Ladungsart der Gegenionen unterscheidet man
Kationen- und Anionenaustauscher. Amphotere Austauscher können beide
Funktionen erfüllen.
Die Ionenaustauscher sind poröse Stoffe, von Kanälen und Hohlräumen
durchzogen und zur Aufnahme von Lösungsmittel fähig (Quellung). Dadurch
kann eine Dissoziation an den austauschaktiven Gruppen erfolgen.
Anorganische Ionenaustauscher
Die Erscheinung des Ionenaustausches wurde an mineralischen Stoffen
entdeckt. Im Boden vorhandene Tone können Calcium- und Magnesiumionen
gegen Kalium- und Ammoniumionen austauschen.
Beispiele ( Aluminiumsilicate => Kationenaustauscher):
* Zeolithe [ z. B. Chabasit (Ca, Na2)(Si4Al2O12 * 6 H2O)]
* Montmorillonite
Organische Ionenaustauscher
Organische Ionenaustauscher enthalten als Matrix Polystyren, welches
bei der Synthese durch den Zusatz bestimmter Mengen Divinylbenzen
vernetzt wurde.
 Kapazität von Ionenaustauschern
Kapazität von Ionenaustauschern
Eine der wichtigsten Größen zur Charakterisierung eines
Ionenaustauschers ist seine Kapazität, das Aufnahmevermögen für
austauschbare Gegenionen. Sie wird entweder durch dividieren der
Objektmenge der austauschbaren Ionenäquivalente durch die Masse des
lufttrockenen Austauschers (Massenkapazität) oder durch das Volumen des
gequollenen Austauschers (Volumenkapazität) ermittelt.
Gleichgewichtskonstante und Selektivitätskoeffizient:
Die obige Gleichung beschreibt dabei einen Kationenaustauscher in der
Natriumform, welcher mit einer Kalium(chlorid)lösung im Gleichgewicht
steht.
Bei der Einstellung des Gleichgewichtes ist es jedoch unerheblich, ob
die Natriumform mit einer Kaliumchloridlösung als Ausgang diente oder
die Kaliumform mit einer Natriumchloridlösung.
Der Selektivitätskoeffizient K (sprich die konditionelle Gleichgewichtskonstante) ergibt sich dann entsprechend Gleichung 1.
Eine weitere wichtige Größe ist das so genannte Verteilungsverhältnis,
welches die Konzentrationsverhältnisse eines Ions in Lösung und im
Austauscher wiedergibt (Gleichung 2).
Und zur Beschreibung der Wirksamkeit, bei der Trennung zweier Ionen wird der Trennfaktor T benutzt (Gleichung 3).
Anwendung:
* Entmineralisierung von Wasser (Deionat - ist kein destilliertes Wasser)
* Beseitung störender Ionen bei analytischen Prozessen
* Anreicherung von Ionen
 Ionenaustauscher:
Ionenaustauscher sind Feststoffe, die in einer reversiblen Umsetzung
aus einer Lösung Ionen entfernen und dafür eine äquivalente Menge
anderer Ionen in die Lösung abgeben.
Ionenaustauscher:
Ionenaustauscher sind Feststoffe, die in einer reversiblen Umsetzung
aus einer Lösung Ionen entfernen und dafür eine äquivalente Menge
anderer Ionen in die Lösung abgeben.  Kapazität von Ionenaustauschern
Kapazität von Ionenaustauschern