Beeinflussung von
Fällungsgleichgewichten
Einfluß gleichioniger Zusätze
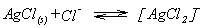 Gleichionige
Zusätze verschieben die Reaktion als erste in der durch das Le
Chatelie=sche Prinzip vorgegebenen Art und Weise. Es gilt dabei jedoch
zu beachten, daß sich verschiedenen Niederschläge infolge von
Komplexbildung wieder auflösen können. So ist z.B. Silberchlorid in
einem Überschuß von Salzsäure merklich löslich.
Gleichionige
Zusätze verschieben die Reaktion als erste in der durch das Le
Chatelie=sche Prinzip vorgegebenen Art und Weise. Es gilt dabei jedoch
zu beachten, daß sich verschiedenen Niederschläge infolge von
Komplexbildung wieder auflösen können. So ist z.B. Silberchlorid in
einem Überschuß von Salzsäure merklich löslich.
Einfluß fremdioniger Zusätze
 Der Einfluß fremdioniger Zusätze ist ein weniger komplexer und Bedarf
daher einer näheren Betrachtung.
Der Einfluß fremdioniger Zusätze ist ein weniger komplexer und Bedarf
daher einer näheren Betrachtung.
A) Beeinflussung der Ionenstärke
Die Ionenstärke ist entsprechend Gleichung 1 definiert.
Darin bedeutet ci die Konzentration eines Ions und zi ist dessen
Ladungszahl.
Zwischen dem Aktivitätskoeffizenten und der Ionenstärke besteht ein
empirischer Zusammenhang (Gleichung 2).
Daraus folgt, daß mit zunehmender Elektrolytkonzentration die
Löslichkeit einer Fällung zunimmt.
B) Beeinflussung durch Folgereaktionen
Kopplung mit Säure-Base Gleichgewichten, wenn das Anion des
schwerlöslichen Elektrolyten, eine Brönstedt Base ist. Beispiel
Kupfersulfidfällung (vgl. Abbildung)
Anwendung von Fällungsgleichgewichten
 a) analytische Anwendungen
a) analytische Anwendungen
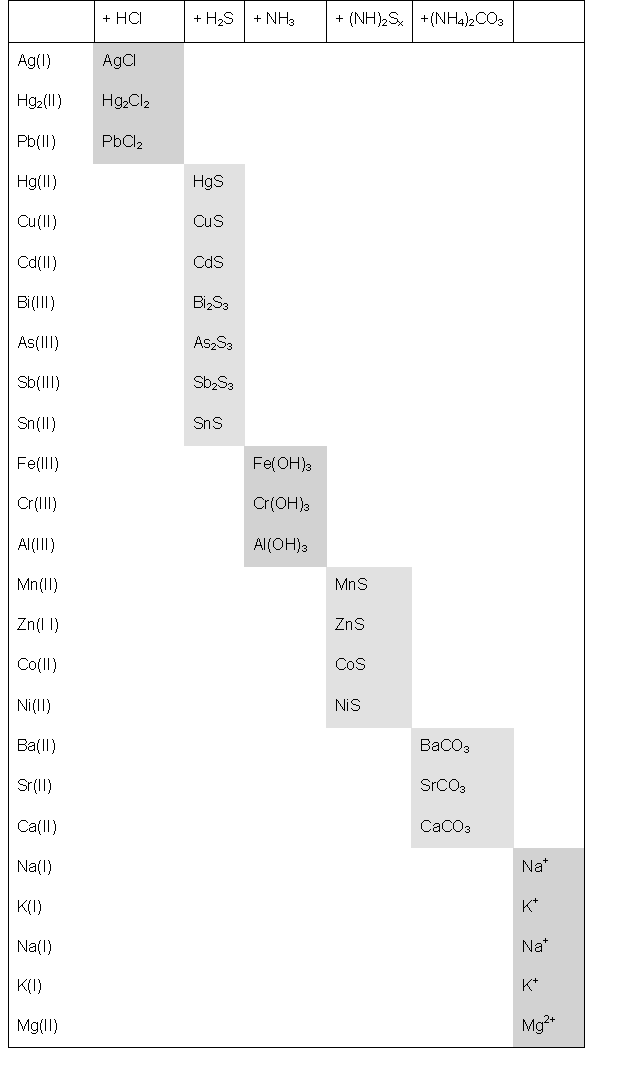
Die Trennungsgänge bilden die Grundlage jeder systematischen,
qualitativen Analyse. Als Beispiel soll hier kurz der
Schwefelwasserstoff- Trennungsgang kurz besprochen werden.
Der H2S- Trennungsgang beruht auf der
unterschiedlichen
Löslichkeit der Sulfide und Hydroxide, welche man zu Fällungsgruppen
zusammenfaßt. Die Trennung erfolgt dabei in 6 Gruppen:
*Salzsäure - Gruppe: Schwerlösliche Chloride.
*H2S- Gruppe: In mineralsaurer Lösung fallen
schwerlöliche Sulfide aus (pKL >25).
*Ammoniak - Gruppe: Ausgefällt werden die Hydroxide 3- wertiger
Metallionen in Gegnwart von Ammoniumchloride ( pKL
> 30).
*Ammoniumsulfid- Gruppe: Es werden hier die schwerlöslichen Sulfide mit
pKL < 25 aus ammoniakalischer Lösung
ausgefällt.
*Ammoniumcarbonat- Gruppe: Die mit Ausnahme von Magnesiumcarbonat
schwerlöslichen Erdalkalicarbonate werden ausgefällt.
*Rest: Für die verbleibenden Ionen gibt es kein gemeinsames
Fällungsreagenz.
Kristallfällungen
Manche Verbindungen besitzen neben einer typischen Farbe auch noch
einen typischen Kristallhabitus. Dieser kann zum mikrochemischen
Nachweis heran gezogen werden.
Gravimetrie
Als Gravimetrie (Masseanalyse) bezeichnet man ein Bestimmungsverfahren,
bei dem der zu erfassende Stoff in Form eines schwerlöslichen
Niederschlages abgeschieden, die Fällung abgetrennt und ( nach
geeigneter Weiterbehandlung) aus der gefundenen Masse auf den Gehalt
der Probe an dem zu bestimmenden Bestandteil geschlossen wird.
Fällungstitrationen
 Fällungsreaktionen,
die exakt stöchiometrisch und momentan ablaufen und deren
Reaktionsgleichgewicht praktisch vollständig auf der rechten Seite
liegt, können auch für maßanlytische Bestimmungen eingesetzt werden.
Meist werden auch hier zur Endpunktsbestimmung spezielle Indikatoren
eingesetzt.
Fällungsreaktionen,
die exakt stöchiometrisch und momentan ablaufen und deren
Reaktionsgleichgewicht praktisch vollständig auf der rechten Seite
liegt, können auch für maßanlytische Bestimmungen eingesetzt werden.
Meist werden auch hier zur Endpunktsbestimmung spezielle Indikatoren
eingesetzt.
Technische Anwendungen:
* Wasseraufbereitung
* Pigmente
* Bayer- Verfahren
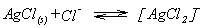 Gleichionige
Zusätze verschieben die Reaktion als erste in der durch das Le
Chatelie=sche Prinzip vorgegebenen Art und Weise. Es gilt dabei jedoch
zu beachten, daß sich verschiedenen Niederschläge infolge von
Komplexbildung wieder auflösen können. So ist z.B. Silberchlorid in
einem Überschuß von Salzsäure merklich löslich.
Gleichionige
Zusätze verschieben die Reaktion als erste in der durch das Le
Chatelie=sche Prinzip vorgegebenen Art und Weise. Es gilt dabei jedoch
zu beachten, daß sich verschiedenen Niederschläge infolge von
Komplexbildung wieder auflösen können. So ist z.B. Silberchlorid in
einem Überschuß von Salzsäure merklich löslich.
 Der Einfluß fremdioniger Zusätze ist ein weniger komplexer und Bedarf
daher einer näheren Betrachtung.
Der Einfluß fremdioniger Zusätze ist ein weniger komplexer und Bedarf
daher einer näheren Betrachtung.  a) analytische Anwendungen
a) analytische Anwendungen  Fällungsreaktionen,
die exakt stöchiometrisch und momentan ablaufen und deren
Reaktionsgleichgewicht praktisch vollständig auf der rechten Seite
liegt, können auch für maßanlytische Bestimmungen eingesetzt werden.
Meist werden auch hier zur Endpunktsbestimmung spezielle Indikatoren
eingesetzt.
Fällungsreaktionen,
die exakt stöchiometrisch und momentan ablaufen und deren
Reaktionsgleichgewicht praktisch vollständig auf der rechten Seite
liegt, können auch für maßanlytische Bestimmungen eingesetzt werden.
Meist werden auch hier zur Endpunktsbestimmung spezielle Indikatoren
eingesetzt.