Selektivität von Fällungen
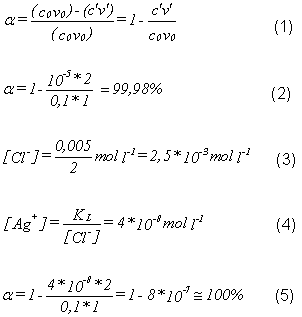 Von
analytischer Bedeutung sind hierbei z. B. die fraktionierte Fällung der
Silberhalogenide. Für solche Anwendungen ist dann die Frage der
Selektivität der Fällung, d. H. die Frage nach dem Stoff, welcher
zuerst ausfällt, wichtig. Setzt man z. B. einer Lösung, welche Cl- und I--
Ionen enthält eine Lösung mit Ag - Ionen langsam
hinzu, so fällt logischer Weise der Stoff, mit der geringeren
Löslichkeit zuerst aus.
Von
analytischer Bedeutung sind hierbei z. B. die fraktionierte Fällung der
Silberhalogenide. Für solche Anwendungen ist dann die Frage der
Selektivität der Fällung, d. H. die Frage nach dem Stoff, welcher
zuerst ausfällt, wichtig. Setzt man z. B. einer Lösung, welche Cl- und I--
Ionen enthält eine Lösung mit Ag - Ionen langsam
hinzu, so fällt logischer Weise der Stoff, mit der geringeren
Löslichkeit zuerst aus.
Da KL (AgCl) > KL(AgI) wird die Konzentration an Silberionen in
der
Lösung so lange durch das Löslichkeitsprodukt von Silberiodid bestimmt,
bis alles Silberiodid ausgefallen ist. Gibt man das Fällungsmittel
(Silber) zu schnell zu, wird sich im ersten Moment ein Bodenkörper aus
AgI und AgCl bilden, jdoch wird sich nach kurzer Zeit da Silberchlorid
wieder auflösen.
Der Fällungsgrad
Das Löslichkeitsprodukt gibt Auskunft über die Sättigungskonzentration
einer Verbindung unter der Voraussetzung, daß äquimolare Mengen der
Reaktanten eingesetzt wurden. Gibt man jedoch das Fällungsreagenz im
Überschuß hinzu, so verschiebt sich das Fällungsgleichgewicht
entsprechend dem Prinzip von Le Chatelier. Daher wurde der Fällungsgrad
alpha eingeführt (Gleichung 1). Dabei beziehen sich die Größen auf das
abzuscheidende Ion und es gilt:
Ausgangsmasse in der Lösung = c0v0
Verbleibende Masse in der Lösung = c'v'
Beispiel:
Fällung von Silberchlorid aus einer 0,1M Silbernitratlösung mit dem
gleichen Volumen an 0,1M Salzsäure (Gleichung 2). Dabei wird die
Silberionenkonzentration aus dem Löslichkeitsprodukt erhalten. Die 2
kommt durch das doppelte Volumen der resultierenden Lösung zustande.
Benutzt man nun einen Überschuß an Fällungsmittel, z. B. eine 0,105M
Salzsäure ( mit gleichem Volumen wie oben), so ergibt sich eine
Gleichgewichtskonzentration an Chloridionen entsprechend Gleichung 3.
Vernachlässigt man die aus dem Silberchlorid stammenden Chlorid- Ionen,
so erhält man für die Silberionenkonzentration Gleichung 4.
Für den Fällungsgrad alpha resultiert dann Gleichung 5.
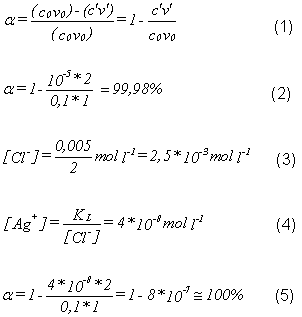 Von
analytischer Bedeutung sind hierbei z. B. die fraktionierte Fällung der
Silberhalogenide. Für solche Anwendungen ist dann die Frage der
Selektivität der Fällung, d. H. die Frage nach dem Stoff, welcher
zuerst ausfällt, wichtig. Setzt man z. B. einer Lösung, welche Cl- und I--
Ionen enthält eine Lösung mit Ag - Ionen langsam
hinzu, so fällt logischer Weise der Stoff, mit der geringeren
Löslichkeit zuerst aus.
Von
analytischer Bedeutung sind hierbei z. B. die fraktionierte Fällung der
Silberhalogenide. Für solche Anwendungen ist dann die Frage der
Selektivität der Fällung, d. H. die Frage nach dem Stoff, welcher
zuerst ausfällt, wichtig. Setzt man z. B. einer Lösung, welche Cl- und I--
Ionen enthält eine Lösung mit Ag - Ionen langsam
hinzu, so fällt logischer Weise der Stoff, mit der geringeren
Löslichkeit zuerst aus.