Extraktions- und
Verteilungsgleichgewichte
 Verteilungsgleichgewichte
entstehen, wenn Stoffe zwischen 2 Phasen austauschen.
Verteilungsgleichgewichte
entstehen, wenn Stoffe zwischen 2 Phasen austauschen.
Extraktion: Unter einer Extraktion versteht man das
vollständige oder teilweise Herauslösen bestimmter Bestandteile eines
flüssigen oder festen Stoffgemisches durch ein geeignetes Lösungsmittel
(Diffusionsprozeß).
Die Extraktion eines festen Stoffgemisches wird dabei als auslaugen
bezeichnet. Bei der Extraktion eines flüssigen Stoffgemisches spricht
man auch von einer flüssig- flüssig Extraktion.
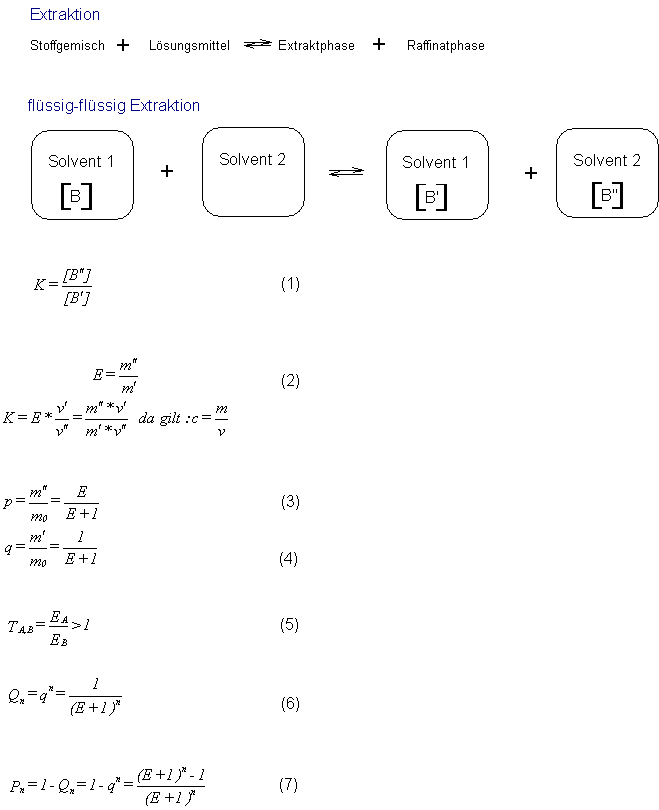
Flüssig-Flüssig Extraktionen
Flüssig-Flüssig Extraktionen verlaufen nach dem rechts angegebenen
allgemeinen Schema. In Kurzfassung: kann man auch schreiben:
L1 [B] L2 --> L1[B'] L2 [B'']
Unter idealen Bedingungen ( a=c und f=1 ) stellt sich dann
einGleichgewicht ein (dabei wird ein Ausbleiben chemischer Reaktionen
vorausgesetzt!), für das Gleichung 1 gilt.
Diese Beziehung wird auch als Nernst'scher Verteilungssatz bezeichnet
und K stellt den Verteilungskoeffizienten dar.
Ein gelöster Stoff verteilt sich so zwischen zwei nicht miteinander
mischbaren Lösungsmitteln, daß das Konzentrationsverhältnis dieses
Stoffes in den beiden Phasen nach Einstellung des Gleichgewichtes bei
konstanter Temperatur einen konstanten Wert hat.
Zu beachten ist, daß mit dem Verteilungskoeffizienten immer angegeben
werden muß, welche Phasen für die Konzentrationsgrößen im Zähler bzw.
Nenner verwendet wurden. Häufig schreibt man die
Verteilungskoeffizienten so, daß die wäßrige Phase im Nenner und die
organische Phasen im Zähler stehen; manchmal formuliert man den
Quotienten entsprechend dem Dichteunterschied der Phasen, d.h. die
Konzentration der spezifisch leichteren Phase erscheint im Zähler.
Häufig wird auch die Extraktionszahl E zur Charakterisierung dieses
Gleichgewichtes benutzt (Gleichung 2).
Dividiert man die Substanzmassen in den einzelnen Phasen durch die
Ausgangsmasse m0 des verteilten Stoffes, so erhält man die relativen
Substanzmengen in den beiden Phasen (Gleichung 3 und 4).
Will man zwei Stoffe A und B mittels Extraktion trennen, so spielt eine
weitere Größe, der Trennfaktor T, eine große Rolle. Der Trennfaktor T
wird dabei entsprechend Gleichung 5 gebildet (er ist immer größer 1 zu
wählen).
Da nur bei sehr hohen Verteilungskoeffizienten eine hinreichend gute
Überführung der Substanz von der einen Phase in die andere Phase
möglich ist, ist es i. A. nötig, mehrfach zu extrahieren.
Bei der ersten Extraktion geht die relative Substanzmenge p in das
Extrakt über, im Raffinat verbleibt die relative Substanzmenge q. Bei
der nächsten Extraktion mit einem reinen Extraktionsmittel geht nun pq
in das Extrakt über und es verbleibt die relative Substanzmenge q2 im
Extrakt. Nach n derartigen Ausschüttelungen verbleibt im Raffinat die
relative Substanzmenge Qsub>n (vgl. Gleichung 6).
In den vereinigten Extrakten befindet sich die relative Substanzmenge
Pn.
Aus diesen Beziehungen folgt, daß es zweckmäßiger ist, bei einem
vorgegebenen Volumen eines Extraktionsmittels mit diesem in kleineren
Portionen mehrere Verteilungen durchzuführen, als nur eine einzige
Extraktion mit dem Gesamtvolumen.

Trenneffekte können jedoch nicht verbessert werden!
Für diese Art der Reinigung eines Stoffgemisches ist es besser, nach
der Extraktion 1 die Phase '' wieder mit reiner Phase ' zu versetzen.
Man nennt dies dann retrogrades Ausschütteln oder Retroextraktion.
Extraktionssysteme
Extraktion einfacher Moleküle mit inertem Lösungsmitteln
Die Verteilung einfacher kovalenter Moleküle zwischen zwei nicht
mischbaren Fküssigkeiten (z. B. Wasser und ein organischen Solvent) mit
denen keine wesentlichen Wechselwirkungen bestehen, erfolgt stets
zugunsten der organischen Phase. Als Grund kann die unterschiedliche
Löslichkeit kovalenter Verbindungen in diesen Lösungsmitteln angesehen
werden. Wassermoleküle bilden in Wasser starke H- Brücken zueinander
aus, in organischen Lösungsmitteln sind solche Wechselwirkungen
schwächer. Daraus folgt, daß der energetische Aufwand zur Erzeugung
eines Hohlraumes für das zu lösende Molekül im organischen Solvent
wesentlich geringer ist.
Das bedeutet weiterhin, daß mit steigender Molekülgröße der kovalenten
Verbindung deren Löslichkeit in der organische Phase zunimmt.
 Extraktion
im Zusammenhang mit chemischen Reaktionen
Extraktion
im Zusammenhang mit chemischen Reaktionen
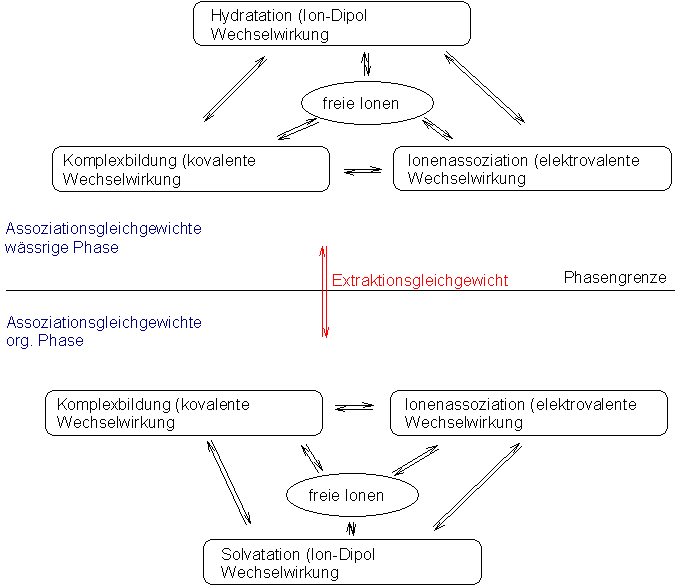
Bei der Überführung von Elektrolyten aus wäßrigen Lösungen in
organische Lösungsmittel spielen eine Reihe von chemischen Reaktionen
eine wichtige Rolle. So ist bei Metallionen die Verdrängung von
Wassermolekülen aus der Koordinationssphäre erforderlich (dies gelingt
z. B. durch die Umsetzung mit Chelatbildnern).
Die einfachste Methode zur Extraktion von Metallionen besteht in der
Bildung neutraler, hydrophober Moleküle. Diese Reaktion kann sich
entweder in der wäßrigen Phase oder an der Phasengrenze abspielen.
Dabei werden als wirksame Reagenzien Chelatbildner (Chelatextraktion),
Mono- oder Diester der Phosphorsäure sowie Carbonsäuren als auch
Sulfonsäuren (flüssiger Kationenaustausch) angewandt.Von den
Chelatbildnern sind solche Verbindungen am effektivsten, die sowohl die
Ladung des Metallions kompensieren können als auch in der Lage sind,
alle Koordinationsstellen zu besetzen.
Beeinflussung von Extraktionsgleichgewichten:
Aussalzeffekt: Die Extraktion von Metallionen kann durch den Zusatz von
Salzen gefördert werden. Dieser als Aussalzeffekt bekannt gewordene
Effekt beruht anschaulicher Weise auf einer Änderung der
Aktivitätskoeffizienten. Bildlich gesprochen müssen die Salze durch das
Wasser hydratisiert werden und tragen somit zur Dehydratisierung der
Metallionen bei (Abnahme der Konzentration an "freien Wasser").
Weiterhin können Extraktionsgleichgewichte auch durch die Anwendung
mehrerer Extraktionsmittel beeinflußt werden. Man spricht dann auch vom
synergetischen oder synergistischen Effekt.
Anwendung der flüssig- flüssig Extraktion
Technisch gibt es heute eine Reihe von Anwendungsmöglichkeiten, so bei
der Urangewinnung aus armen Erzen als auch bei der Aufarbeitung von
Kernbrennstäben.
Analytisch spielen sie z.B. bei Anreicherungen bzw. Trennung (häufig in
Kombination mit Photometrie) eine Rolle. Desweiteren bildet sie die
Grundlage der Verteilungschromatographie.
 Extraktion
im Zusammenhang mit chemischen Reaktionen
Extraktion
im Zusammenhang mit chemischen Reaktionen Verteilungsgleichgewichte
entstehen, wenn Stoffe zwischen 2 Phasen austauschen.
Verteilungsgleichgewichte
entstehen, wenn Stoffe zwischen 2 Phasen austauschen. 
 Extraktion
im Zusammenhang mit chemischen Reaktionen
Extraktion
im Zusammenhang mit chemischen Reaktionen